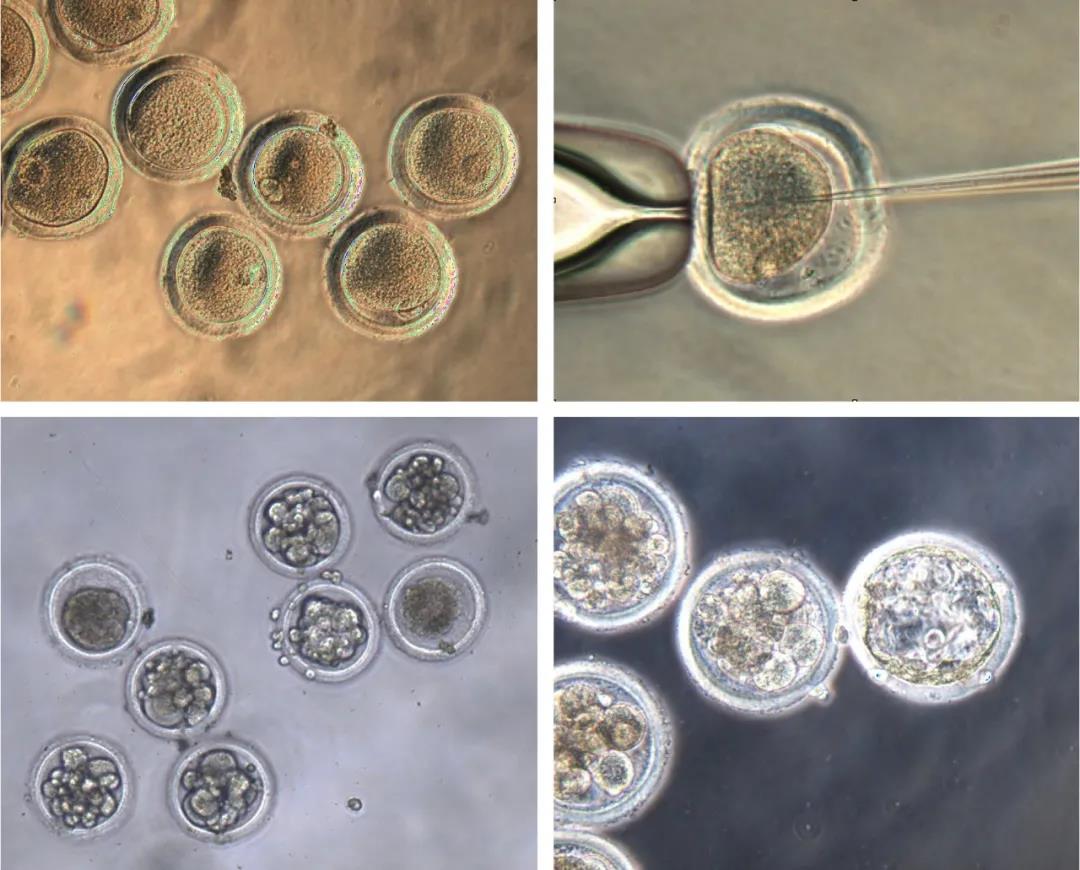
图释:从毛里求斯食蟹猕猴身上采集的卵细胞(左上角)受精(右上角),并注入CRISPR基因编辑材料,插入一个基因突变,在过去十年中,这种基因突变治愈了两名男子的艾滋病毒。成长中的胚胎(底部图片中正在发育)如果被代孕者携带至成熟,将帮助研究人员研究该突变作为治疗艾滋病毒的潜在方法。
十年前,一名感染艾滋病毒男子因一种基因被治愈,现在这种基因已成功添加到发育中的猴子胚胎中,以研究更多潜在的疾病治疗方法。
多年来被称为 “柏林病人 “的蒂莫西-布朗(Timothy Brown)在2007年接受了骨髓干细胞的移植,以治疗白血病。这些细胞来自一个罕见的基因突变的捐赠者,使他们的白血球表面没有一种叫做CCR5的蛋白质。当布朗的免疫系统被消灭并被捐献的细胞所取代时,他的新免疫系统的细胞携带了改变的基因。
“这种基因突变把基因组切掉了一大块,这样就失去了一个功能性基因CCR5,它是HIV的共同受体,”威斯康星大学麦迪逊分校生殖科学家、比较生物科学和妇产科学教授Ted Golos说。”如果没有CCR5,病毒无法附着并进入细胞制造更多的HIV。所以,在蒂莫西-布朗的案例中,他的感染被消除了。”
2019年,第二位癌症患者亚当-卡斯蒂列霍(Dam Castillejo,最初被认定为 “伦敦患者”)通过赋予同样突变的干细胞移植清除了他的HIV。
“这是非常令人兴奋的,而且已经有一些后续研究。但至少这很复杂。”Golos说。
在这两次移植之间,出现了一次更臭名昭著的基因突变技术应用实例,2018年,中国生物物理学家贺建奎宣布,他利用DNA编辑工具CRISPR将这种突变写入一对人类胚胎的DNA中。他的工作引起了关注改变可遗传给人类后代的基因的伦理道德的科学家的批评,他以欺诈罪被关进监狱。
CCR5突变的前景仍然存在,但并非没有进一步研究。该突变在不到1%的人中自然发生,这表明它可能不仅与积极的健康结果有关。研究的动物模型可以帮助回答开放的问题。
“鉴于人们对推进基因编辑技术以纠正遗传疾病的兴趣,在非人灵长类动物中进行胚胎编辑的临床前研究是非常关键的,”干细胞研究员Igor Slukvin说,他是UW-Madison的病理学和实验室医学教授。
Golos、Slukvin和UW-Madison的威斯康星国家灵长类研究中心、兽医学院和医学与公共卫生学院的同事们,采用CRISPR来编辑猕猴新受精胚胎的DNA。他们最近在《科学报告》杂志上发表了他们的工作。
Slukvin的实验室已经建立了一种方法,将产生CCR5的基因从人类多能干细胞中的DNA中切出,可以用来产生抗HIV的免疫细胞。
“我们使用了我们已经知道在细胞中起作用的相同的靶向构建体,并将其传递到单细胞受精胚胎中,”威斯康星州国家灵长类研究中心的科学家Jenna Kropp Schmidt说。”我们的想法是,如果你在早期胚胎中进行基因编辑,它应该随着胚胎的成长而在所有细胞中传播。”
灵长类动物中心科学家Nick Strelchenko发现,多达三分之一的时间,基因编辑成功地删除了CRISPR瞄准的DNA部分,一个染色体上CCR5基因的两个拷贝中的碱基对,并随着胚胎的生长被延续到新的细胞中。
“现在的目标是将这些胚胎转移到代孕者身上,以产生携带突变的活后代,”Strelchenko说。
食蟹猕猴原产于东南亚,但一群猴子在印度洋的毛里求斯岛上与世隔绝地生活了约500年。由于整个毛里求斯猴系是少数食蟹猕猴的后裔,它们只有7种主要组织相容性复合体的变异,这组基因必须在供者和受者之间匹配才能成功进行骨髓移植。人类有数百种MHC变异。
有了携带CCR5突变的MHC匹配的猴子,研究人员将有一个可靠的方法来研究移植对模拟免疫缺陷病毒的成功程度,该病毒在猴子中的作用就像HIV在人类中的作用一样。
“抗逆转录病毒药物确实积极地改变了对HIV感染的预期,但在一些患者中,它们可能没有那么有效。而且它们肯定不是没有长期后果,”Golos说,他的工作由美国国家卫生研究院资助。”因此,这是一种潜在的替代方法,这也使我们能够扩大我们对免疫系统的理解,以及它如何保护人们免受艾滋病毒感染。”
该动物模型可能会导致基因编辑人类造血干细胞的开发,这种类型的干细胞在骨髓中工作,以产生多种血细胞。Slukvin和Golos说,这种干细胞可以作为一种现成的治疗HIV感染的方法。